おはようございます。
おはようございます。
循環器専門医の佐々木(医学博士/大阪大)です。
前回は心臓リハビリの中でも一番重要な運動療法について述べましたが、今回は運動する上では欠かせない筋肉についてお話ししようと思います。筋肉は、心臓ポンプの代わりに局所から血液を心臓に戻す補助ポンプのはたらきをします。「脚あしは第二の心臓」という言葉は、以前の記事 (2020年 11月30日) でもご紹介しました」。太ももの筋肉が弱い人ほど、心血管系の死亡のリスクが高くなることも分かっています1。
悲しいことに、何もしなければ、筋肉は日々失われていきます。
ヒトの筋肉は、30代を過ぎる頃から年に1%ずつ減少していくといわれています。筋肉は何もしなければ、50代では30代の20%、70代では実に40%も失われていく計算になります。 下記のような正しい順序で行えば、80歳代でも筋肉を増やすこと(貯筋)はできます。
①適正な栄養・・・タンパク質などの、筋肉の元になる栄養補給
②レジスタンス・トレーニング(筋トレ)・・・筋肉・筋力を育てる
③有酸素運動・・・筋肉を使いこなし持久力・運動耐容能をのばす
④適度な休養・・・休んでいる間に筋肉が育つ
心血管疾患のある方にとっても運動は非常に重要です。ただし、体力のない人、筋肉が少ない人が自己流で筋トレやジョギングなどを始めても、筋肉を傷め、余計に消耗してしまいがちです。できるだけ医療者のアドバイスに従って続けることをお勧めします。
今回は特に②の筋肉・筋力を育てるにはどうすればいいかお話ししたいと思います!
健康寿命を延ばすには筋肉をきたえよ!
日本では高齢化社会が進んでいて、介護を必要とする高齢者の数も激増しております。心なしか、介護主治医意見書を書く枚数も最近多い気がします。
社会的にも医療経済的にも大きな問題で介護が必要な高齢者を少なくしようというのはもはや耳にタコですね。一番の問題は、自分自身が死ぬまでの人生の最終章を人に頼って自分の思うようにならない生活を送らないといけないってことですよね。
外来で医師が患者さんの採血データをみながら、「肝臓や腎臓の機能が落ちてますねぇ」、って言うことはあっても筋肉の機能が低下してますねぇとは言うことは少ないですよね。まずは健康寿命を延ばすために、いつまでもしっかり自分の足で歩けることを目標に、筋肉にもう少し気を配りましょう!っていう話をしたいと思います。

老化は足から? いくつになっても大股で早く歩こう!
おしゃれは足元から、老化も足元から?
最後まで自立して自分らしい人生を生きる年月を健康寿命といいます。それを延ばすには、高齢になった時点でしっかり速く歩けることが不可欠です。
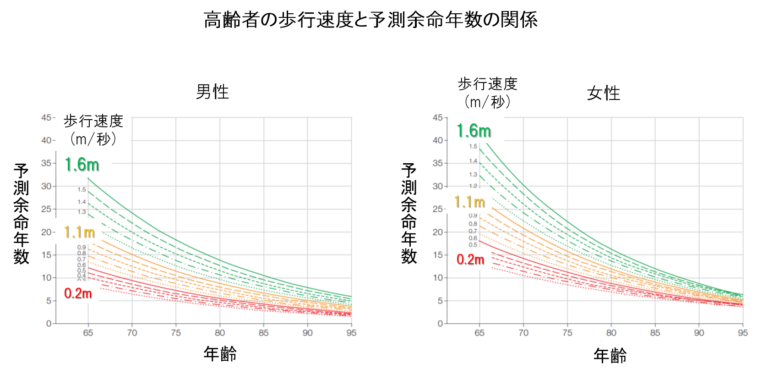
それを実証したのが、アメリカで約3万4千人を対象に21年間、追跡調査した大規模な疫学研究の中の一つのデータです2。65歳以上の方の歩行速度と生存率を追跡したものですが、それによると同じ65歳でも歩行速度によって寿命(余命)に大きな差が出ています。
たとえば、次の図のように秒速1.6mで歩く人は、秒速1.1mで歩く人より男性では12年、女性では14年も余命が違います。
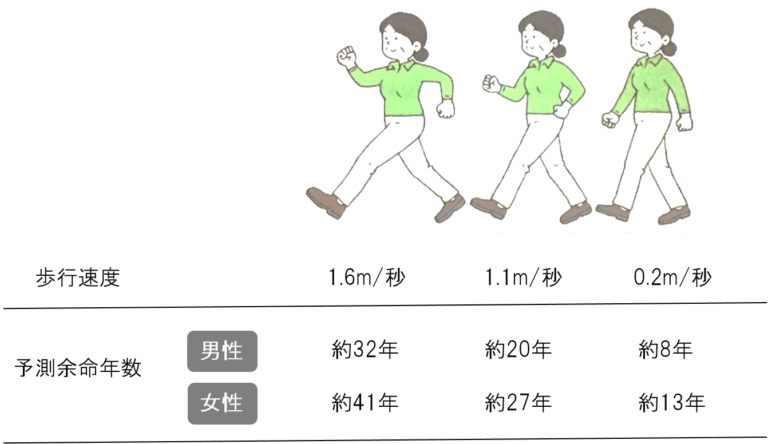
まさに脚力がその先の人生を変えていくといっても過言ではありません。意外なことに血圧でもなく血液検査の値でもなく、一番歩くスピードが問題なんです。大股で速く歩く人は健康寿命を延ばすことができるんです。
その理由は、脚は第2の心臓と呼ばれるように、脚の筋肉を維持することが全身の健康維持にもつながっているからです。脚の筋肉は食事と運動でいつでも取り戻せるので、しっかり対策していきたいですね。
筋肉減少症のサルコペニアとは一体?
加齢に伴う筋肉量の減少は、1989年にRosenbergによって初めてサルコペニア (加齢性筋肉減少症) と提唱されました。ギリシヤ語で「サルコsarx」(筋肉)と「ペニアpenia」(減少)が語源の造語です。
2010年には欧州サルコペニア・ワーキンググループ(EWGSOP)が診断基準に関するコンセンサスを発表し3、サルコペニアとは「身体的な障害やQOLの低下、および死などの有害な転帰のリスクを伴うものであり、進行性および全身性の骨格筋量および筋力の低下を特徴とする症候群」と定義されました。
“死などの有害な転帰のリスクを伴う”ってなんか、ヤバそうですよね。。
筋肉量は50歳以降、特に下肢で減少し、85歳以上では20代に比べて約60%まで減ってしまいます。65歳以上の方で、筋肉の減少に伴って筋力が衰え、移動や外出、買い物などの日常生活にも支障が生じてくるのがサルコペニアです。
ダウンタウンの松ちゃんやTMレボリューションの西川君は50代なのに凄いよなぁ。。。

サルコペニアは、加齢のみが原因である一次性(原発性)サルコペニアと、加齢以外の原因が明らかある二次性サルコペニアに分類されます4。
二次性サルコペニアの原因には、低活動、低栄養(エネルギーやタンパク質の摂取不足や吸収不良)、疾患(急性感染症、外傷、骨折などの急性炎症や、がん、慢性臓器不全などの慢性炎症など)が含まれます。二次性サルコペニアは年齢を問いません。
サルコペニアの診断は国際的に複数ありますが、欧米人とアジア人の骨格は異なるため、日本では2014年にアジアサルコペニア・ワーキンググループ(AWGS) 5から発表された日本人の体格でも対応できるアジア人特有の診断基準が使われることが多いです。
定義にともなって筋肉量の減少が必須条件で、それに加えて筋力の低下あるいは身体機能の低下が合併した場合、サルコペニアと診断します(下図) 。AWGSの診断基準において、骨格筋量の評価にはDXA(二重エネルギーX線吸収法)やBIA(生体電気インピーダンス法)が用いられ、四肢除脂肪量または四肢骨格筋量を測定し、身長の2乗で補正する方法がとられています。
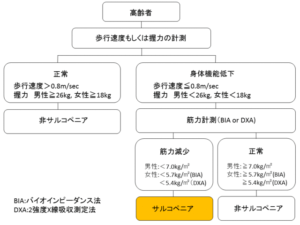
2019年11月9日・10日に新潟で開催された第6回日本サルコペニア・フレイル学会大会で、本邦で初めて公表されたAWGSによる2019年度のサルコペニア基準もご紹介します。
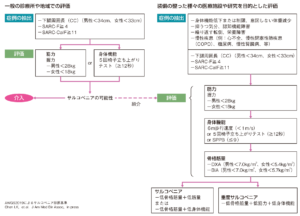
2014年の診断基準との大きな変化は、かかりつけ医や地域の場で骨格筋量の評価が難しいといったこれまでの限界を踏まえた上で、下腿周径の評価で基準値よりも低値な場合や、握力・5回椅子立ち上がりテストを用いて、サルコペニアの可能性(Probable Sarcopenia)として介入が可能な点です。
正直なところ、実地臨床ではBIAがいくらとか、DXAがいくらとか言われてもピンときませんし、そもそも機械自体がなくて評価ができない施設もあるかと思います。
今回の基準では非常に身近な下腿周囲長の基準として男性34cm、女性33cmといった数値が明示されたのは非常に大きいですね。
それから握力の男性のカットオフ値が26kg→28kgへ変更となりました。ちなみに女性は18kgのままです。
さらに歩行速度は1.0m/秒に変更になりました。正直なところ0.8m/秒というのは少し遅い印象でしたし、日本では10m歩行時間を計測することが多いので「10mを10秒で歩行できれば良い」といった基準は非常にわかりやすくなりました。
この2019年版のAWGSをふまえた上で、近々サルコペニア診療ガイドラインが改訂される予定のようで注目です。
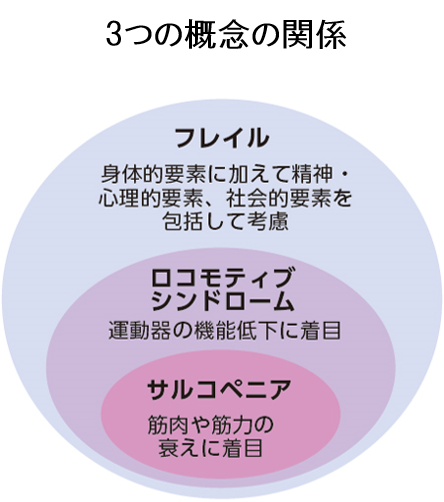
日本整形外科学会が提唱した運動器症候群:ロコモティブシンドローム(ロコモ)
運動に関わる骨や筋肉、関節や神経などを総称して運動器と言います。これらの機能が低下することによって、移動機能が低下し「要介護になる危険性が高まった状態」が運動器症候群:ロコモティブシンドローム(ロコモ)です。2007年に日本整形外科学会で提唱された概念です。
ロコモは運動器の機能低下に着目するため、筋肉や筋力に着目するサルコペニアより広く、また年齢を問わないため、より予防を重視した概念です。ロコモの原因として、加齢と運動不足による筋力の低下、骨や関節の病気などが挙げられます。骨粗鬆症や変形性膝関節症などの病気がロコモの原因になることがあります。
下の「ロコチェック」で1つでも該当する項目があれば、ロコモが始まっている可能性があります。

さらに詳しい診断のためのロコモの評価には、日本整形外科学会が提案するロコモ度テスト診断基準https://locomo-joa.jp/check/judge/が使われています。これは、下肢筋力(立ち上がりテスト)、歩幅(2ステップテスト)、25項目からなる自己質問票からなる計測と集計点から判定する方法となります。気になる方は、ぜひ一度チェックしてみてください!
介護の原因となるフレイルを回避せよ!
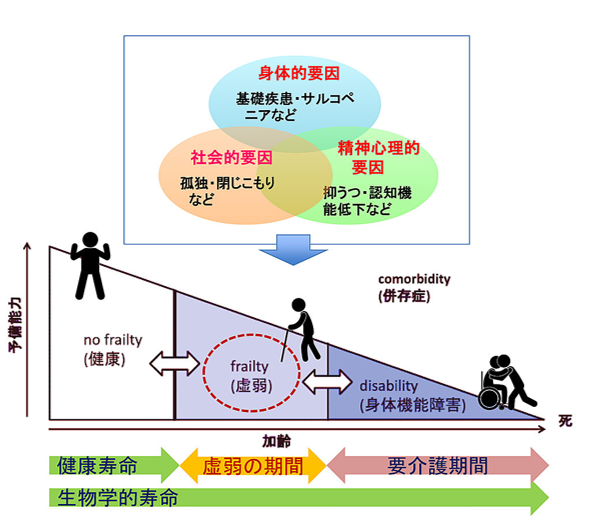
フレイルは英語の「Frailtyフレイルティ」の日本語訳であり、本来は、虚弱・老衰・衰弱・脆弱を意味します。加齢によって運動機能や認知機能が低下した状態で、下図のように“健康”と“身体機能障害”の間に位置する概念です。
完全な身体機能障害となって要介護に至る一歩手前ですが、適切に対応することで、フレイルはまだ“健康”に戻る可能性が残されている状態でもあります。まずは、フレイルに陥らないように早期に介入すること。一時的にフレイルな状態になっても、“障害”ではなく“健康”の方に戻す努力をすること。これらが、医療や福祉に求められる重要な役割であり、医療の究極の目的である“健康寿命”をのばすカギとなります。高齢化社会の日本においては今や国家的課題でもあります。
フレイルはサルコペニアやロコモのような「身体的要因」に加えて、認知症やうつなどの「精神・心理的要因」、ひとり暮らしによる孤独・閉じこもりや貧困などの「社会的要因」を包括した幅広い概念です(下図)。
フレイルの診断方法はさまざまですが、世界的に最もよく使われているのはFriedらの方法です。
【Friedらによるフレイルの定義】
①体重減少
②筋力低下
③疲労感の自覚
④歩行速度の低下
⑤活動性の低下
の5つのうち、3つ以上当てはまる状態。
以下に、各項目について詳しく述べます。
①急激な体重減少
理由もなく1 年間で 4.5 kg 以上減少することは、たいてい脂肪よりも筋肉が減っていることが多く、以前ご紹介したサルコペニアに相当するかもしれません。
②筋力(握力)低下
男性26㎏未満、女性18㎏未満が、これに相当します。握力15㎏以下になると、ペットボトルを開けるのが困難になると言われます。握力低下は、寿命の長さに直結するといわれるほど、重要な目安になります。
③易疲労性
“疲れやすさ(易疲労性)”はフレイルの典型的な症状です。
④歩行速度の低下
横断歩道は、歩行速度1.0m/sで渡り切れるように青信号の時間が設定されています。0.8m/sに満たない歩行速度では、活動能力がかなり落ちていると言えます。
⑤活動レベルの低下
今まで行っていた活動がおっくうになること、しばしば行っていた場所に行かなくなることが、フレイルを判断するきっかけとなる場合があります。
これを日本語訳したものが表1である[J-CHS(Japanese version of the Cardiovascular Health Study)基準]6 5つの項目のうち. 体重減少、筋力低下、歩行速度低下については実測が必要でカットオフ値が設けられています。
3つ以上当てはまる場合はフレイル、1~2項目当てはまる場合はフレイルの前段階であるプレフレイル(準フレイル)、1項目も当てはまらない場合は健常と診断します。
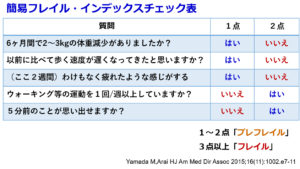
しかし、J-CHS基準は測定器を使う必要があるため、スクリーニングには向いていません。道具を必要としないスクリーニング法(簡易フレイル・インデックス)も提案されています7。
下の表がそれですが、J-CHSを基に5つの項目を自己申告に基づいて判定するようになっています。J-CHS基準同様3項目以上でフレイル、1~2項目でプレフレイル(準フレイル)、0項目で健常と判定します。J-CHS基準との違いは筋力(握力)低下がなくなり、記憶低下が加わっている点です。
J-CHS基準でも簡易フレイル・インデックスにおいても、健常<プレフレイル<フレイルの順で年々、新規要介護認定率が高くなっています。
心疾患とサルコペニア・フレイル
サルコペニアやフレイルの概念や診断基準をお話ししてきましたが、心臓との関連はどうなのでしょうか?
フレイルは高齢心血管疾患患者の25~50%にみられ、心血管疾患とフレイルとの間に関連性が示されています。1960年オランダの40~59歳の男性1088名を対象にしたコホート研究で、フレイルのない男性の28%に心血管疾患の合併を認めたのに対し、フレイルの男性の実に68%に虚血性心疾患の合併が認められています8。
この研究によりフレイルと心血管疾患との関係が初めて明らかにされ、以後次々と同様の報告がなされています。2005年のWHI-OS研究では、冠動脈疾患があるとフレイルへの進展リスクが有意に高いことが報告されていますし9、2006年のHealth ABC研究では、フレイルがあると心血管疾患発症リスクとなることを初めて報告しています10。
循環器疾患でサルコペニア・フレイルとの関連性が最も多く証明されている病態はなんといっても心不全でしょう。
フレイル高齢者の割合は、先のCHS基準で評価したわが国の調査では、地域在住高齢者の約10%前後と推計されています。また、フレイル高齢者は加齢とともに増加し、男性に比較し女性に多いです。223人の心不全患者(平均年齢71±14歳)での検討では、CHS基準で21%がフレイル、48%がフレイル前段階でした。フレイル合併心不全患者で有意に生存率が低かったと報告されています11。
サルコペニアの割合は65~70歳で5~13%、80歳以上では11~50%と報告されています。
一方、心不全を合併したサルコペニアの頻度は200人の心不全患者(平均年齢69±10歳, NYHAⅡ~Ⅲ度)の検討において約20%と報告されています12。
年齢、握力、および下腿周径から計算したサルコペニア・スコアを用いた研究では、サルコペニア合併心不全患者において、合併しない心不全患者より心不全関連イベントが有意に多かったことが報告されています13。
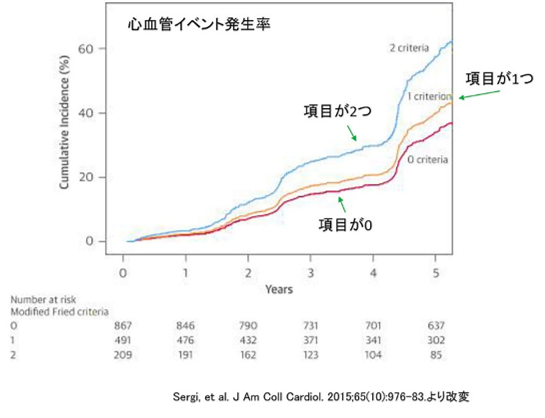
フレイルが進むと、心血管系のリスクが高まるという報告もあります。Sergiらは、もともとはフレイルではない65~96歳の高齢者1,567人を4.4年間追跡し、その間に新たにフレイルとなった場合の心血管疾患の発症リスクを検討しました14。フレイルの徴候として、以下の5項目を挙げ、当てはまった項目の数と発症リスクの関係を調べました。
全部で551人が心血管疾患を発症し、下のグラフのように、要件がゼロ、1つ、2つと増えるごとに、心血管イベントリスクは増大しました。このように、身体的な活動の低下が心血管疾患をも引き起こすことがあります。内分泌系や自律神経系への影響も知られています。
1.エネルギー消費の低下
2. 疲弊
3.歩行速度の低下
4. 虚弱状態
5. 理由のない体重減少
フレイルの悪循環
下の図は「フレイル・サイクル」と呼ばれるものです15。
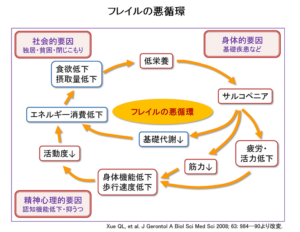
「低栄養状態の持続⇒サルコペニア(筋肉減少)が進行⇒筋力低下⇒活力や身体機能低下⇒活動度低下⇒エネルギー消費の低下⇒食欲低下⇒低栄養状態がさらに持続⇒・・・」と巡り、結果的に負のスパイラルに陥っていきます。しかし、影響はそれだけにとどまりません。
高齢化社会の到来とともに、様々な病気やけがを抱え、複雑な病態に陥りやすく、その分悪循環から抜け出すことが困難になります。活動性が低下すれば認知機能低下や抑うつをきたしやすく、さらに社会から孤立し、孤独や経済的な問題を抱えるリスクが増大します。
このように、フレイル・サイクルの背景には身体的・社会的・精神心理的要因が複雑に絡み合っているのです。
循環器疾患とサルコペニア・フレイルとの間には強い関連性があり、お互い原因にもまた結果にもなりうることを説明しました。サルコペニア・フレイルに陥らないようにするための手段として広く用いられるのが、包括的心臓リハビリテーションなのです!
己の筋肉を知ることから始めよう!
筋肉が大事なのは何となく分かっていただけたかと思いますが、実際の自分の筋肉ってどんな感じで、どれくらい筋肉量や筋力があるのかご存知ない方が多いと思います。ざっくりと筋力がないことは自覚されていても具体的な数字が分かると実感が湧いてきますよ!
筋肉の種類
専門的な話になりますが、図のように筋肉は3種類に分かれます。
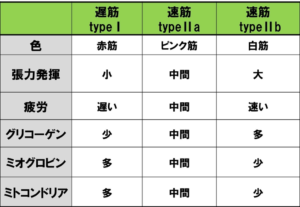
まず、「遅筋Ⅰ」-遅い速度で収縮し、小さな力を長時間発揮しつづける、という役割です。
小さく細い運動神経で、神経の伝導が遅いけど、持久力がある。この筋肉はほとんど真っ赤です。マグロは1日中泳いでエサを食べていて、血管がすごく発達しているから赤いんです。赤身の魚がすぐ腐るのは、血管の中に色々なものが入ってくるからなのです。
二つ目が、「速筋Ⅱa」-「遅筋Ⅰ」と、次の「速筋Ⅱb」の両者の中間とお考えいただければ結構です。
三つ目が「速筋Ⅱb」。陸上競技の短距離走、100メートルのウサイン・ボルトを思い浮かべていただくといいのですが、短い時間に爆発的な力を出す筋肉を支配している運動神経があります。ロケットみたいなもので、点火するとドカッと大きな力が出るんだけど持続しない。2分もしたら、この筋肉は使い物にならなくなります。
魚で言えば、「速筋Ⅱb」は白身の王様の鯛、「遅筋Ⅰ」が赤身のマグロです。付け加えておくと、人間も動物も、生まれてきた時には、主に遺伝的な要素で筋肉のブレンド比率は決定されています。白い「Ⅱb」の筋線維が多めだと、短距離走や体操競技に適性があるわけです。
心不全になると骨格筋が萎縮し、筋線維のⅠ型線維(遅筋)が減り、 Ⅱ型線維(速筋)が増加することが示されています。特にⅡa型からより、すぐにバテてしまうⅡb型へのシフトもみられます。心リハにより、速筋Ⅱ型→遅筋Ⅰ型への筋線維型の変換効果あり 持久力がでてバテにくくなります。
筋力の評価法
筋力テストの方法には、筋収縮、重力にさからった運動および検者の徒手抵抗感を判断基準とする徒手筋力検査法がありますが、段階的な定性的評価(例:0~6段階)であるため、筋力トレーニングの目標値や効果の程度を具体的に提示できません。
臨床場面では、このような欠点を補完する目的から、簡便な握力計やハンドヘルドダイナモメーターを用いて定量化する方法が採用されています。
①握力計
グリップ幅を調節できるスメドレー式の握力計が最も利用されています(下図)。
握り幅は、第2指の近位指節関節がほぼ直角となり、すべての指がしっかりと握れるように調節します。

②等尺性膝伸展筋力
下肢筋力の粗大筋力の指標として、等尺性収縮(関節角度を固定した状態での筋収縮)による膝伸展筋力が広く採用されています。このハンドヘルドダイナモメーターを用いた測定法(下図)では、体重の影響を受けるため、本測定器で出力された筋力値を体重で除した値を解析値とします。
なお、膝伸展筋力体重比が40%を下回ると、平地歩行が困難になるなど、移動動作の自立度の予測としても応用できます。

筋肉量の評価法
前述のAsian Working Group Sarcopenia(AWGS)によるサルコペニアの診断基準において、筋肉量測定はDXA(Dual-energy X-ray Absorptiometry:二重X線吸収法)法やBIA(BioImpedance Analysis:生体電気インピーダンス)法が使用されています。DXA 法が臨床におけるゴールドスタンダードとなっていますが、DXA 法は機械のコストが高く設置スペースも必要となります。BIA法は,簡便かつ非侵襲的であることから、広く用いられています。
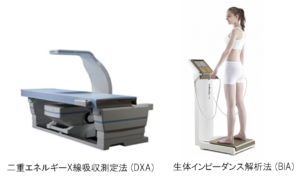
BIA法を用いた代表的なInBody社のInBodyⓇをご紹介します。
筋肉組織など水分を多く含む組織は電流を通しやすいが脂肪組織など水分の少ない組織は電流を通しにくいという特性を利用し、身体に微弱な電流を流した際の電気抵抗値により体脂肪量や除脂肪体重(筋肉量)などの体組成を測定する生体電気インピーダンス(BIA)法を利用した体成分分析装置であり、これを使用することにより全身の筋肉量を間接的に測定することができます。
筋力と同様に、筋肉量の低下している心疾患患者の予後は不良であると報告されており、筋肉量を増加させることもまた、心リハの目標の一つです。InBodyⓇを利用した筋肉量測定は、現状の筋肉量の把握、レジスタンストレーニング導入の判断、心リハの治療効果の判定のための重要な評価項目になります。
心臓ペースメーカーなどの埋め込み式医療電子機器、人工心肺のような電子生命維持装置を装着していない患者さんであれば、誰でも測定できます。
下にInBody測定後の記録用紙の例を提示します。記録用紙には、全身の筋肉量、四肢・体幹の部位別筋肉量の実測値と、予測値に対する実測値の割合(%)が表示されています。筋肉量が標準以下に該当する患者さんにはレジスタンストレーニングの導入を検討します。

上記の情勢患者のSMI(Skeletal Muscle Index: 骨格筋量指標)の計算式
SMI = (右腕(2.02kg)+左腕(1.94kg)+右腕(5.20kg)+左脚(5.02kg))÷身長(1.569m)2
= 5.76 kg/m2
AWGSの提案するサルコペニアの診断基準では、BIA法により求められた四肢の筋肉量の合計を、身長の2乗で除した値である骨格筋量指標(Skeletal muscle Mass Index: SMI)が項目の1つに含まれています。
男性:SMI < 7.0kg/m2、女性:SMI < 5.7kg/m2、であることがサルコペニアの診断基準となります。上記の記録用紙の女性患者を例にSMIを計算すると上記の式となり、SMIは5.76kg/m2であるため、患者はサルコペニアには該当しません。
筋肉づくりは男も女も黙ってレジスタンス・トレーニング
この世界の中で一番一生懸命運動しているのは誰か分かりますか?
それは、宇宙飛行士です。
なぜなら、宇宙空間というのは、究極の無重力だからです。
重力が全くない所にいるのですから、半年もいたら地上に戻ってきて立てなくなってしまいます。 こんな感じで。。。

そうならないように、宇宙空間の中ではレジスタンス(抵抗)をかけて運動します。
そう、これがレジスタンス・トレーニングといわれるもので心リハでは有酸素運動と並んで二大柱です。

「レジスタンス・トレーニング」は日本語訳すると「抵抗訓練」とかいわれます。くわしくいうと、ウエイトマシンやフリーウエイト、ゴムチューブ、あるいは自重などを使って筋肉に抵抗を与え、筋肥大や神経系の活性化を起こし、筋機能を高めるトレーニングです。
筋力を高める運動は、以前は筋力トレーニングいわゆる“筋トレ”と呼ばれることが多かったのですが、筋機能に筋持久力が含まれるという考え方が普及するに従って、それを総称してレジスタンス・トレーニングと呼ぶことが多くなってきました。
心臓疾患に対するレジスタンス・トレーニングは、心臓への負荷による病態の悪化を恐れ、1970年代には禁忌で1990年代に入るまでその発展は遅れました。しかし、レジスタンス・トレーニングは、筋力のみならず筋量を増加させることで基礎代謝量を増加させるため有酸素運動の効果が倍増します。
運動耐容能に直結する下肢筋力・筋肉量は心疾患患者さんでは生命予後を決める因子として確立されており16, 17、今では心疾患全般とくに心予備力の低下した重症心不全患者さんにおいて下肢のレジスタンス・トレーニングはきわめて重要な治療戦略となっています。
レジスタンス・トレーニング導入の実際
心疾患へのレジスタンス・トレーニングの導入時は専門家の監視や指導のもと、一定期間、監視型運動療法に参加して運動に慣れることが重要です。
たとえば心筋梗塞発症後は監視型運動療法へ4週間継続して参加後、最低でも発症から5週間経過していることが原則とされ、経皮的冠動脈形成術後は監視型運動療法へ2週間継続して参加後、術後3週間は経過していること(病態が安定していること)が導入の条件となります。
レジスタンス・トレーニングで最も難しいのが強度設定です。
Repetition Maximum (RM):最大反復回数という意味ですが、1RMとは最大反復回数が1回です。下の写真の人であれば、この運動が1回だけ上げるのが限界で2回目はもう上がらない状態であれば「1RM」ということになります。この運動を10回上げるのが限界で11回目は絶対上がらない状態であれば「10RM」になります。「RM」とは反復させる回数の限界値と考えてください。

心疾患患者にレジスタンス・トレーニングの強度を処方する際には
上肢・・・1RMの30~40%
下肢・・・1RMの50~60%
に設定するとよいといわれています18。
※12~15回で軽く感じたら負荷を5%増加する(マシントレーニングでは1段階ウエイトを増やす)。
上肢は筋肉が下肢に比べて小さく血圧が上がりやすいため負荷は弱めです。
1RMが100kgの人の場合
下肢は50~60kgの負荷で開始すると良いですね。
しかし、心疾患の方で実際に1RMを求めるのはちょっと無理がありますね。
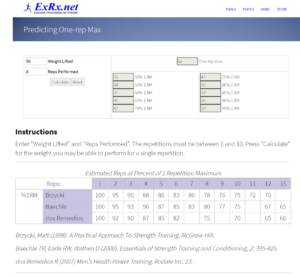
そこで、計算式を用いた外挿法で1RMを計算する。実行可能な重さ1つ決めて実施させると、計算はExRx.net というサイトで行ってくれます。
下図は50㎏の重量を8回出来た場合の結果です。1RMは62kgと計算されています。再現性・正確性については確認されています19。.
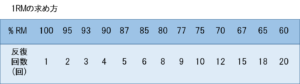
1RMの求め方については下の表に示すものもあり、これを用いてもよいです。
1つの運動を8~15回反復を1セットとして、1~3セットを2~3日/週を行うことが推奨されています。特に導入時には10~15回繰り返しできるような低めの抵抗(1-RMの40%程度)から開始し、週2回の各1セットから開始することが推奨されています20。
筋肉は、実は休んでいる時に育ちます。これを筋肉の超回復といって、同じ筋群のトレーニングには48時間の間隔をあけます。適度に運動した後に十分な休養を取ることにより、代謝や自律神経作用を改善し、筋肉同化作用を促進します。普段頑張りすぎる人ほど、ぜひ休養を意識するようにしましょう。
2011年にヨーロッパ心臓病学会(ESC)のPosition Statement 「Exercise training in heart failure」のように、レジスタンス・トレーニング導入時には、目的を「運動の正しい方法や感触を覚えること」として、preliminary training(予備トレーニング)から開始し、準備の段階を設けて、徐々に強度や回数を上げていくことのほうがより安全であり、実践的で、継続性も高いとされています21。
まず運動の習慣をつけるなら、下の運動くらいから開始してもいいのかもしれませんね笑。
さすがに低強度すぎますが。。。
サルコペニア・フレイル高齢患者に対するレジスタンス・トレーニング
身体活動が制限されるような心疾患や心不全患者さんでは骨格筋萎縮・筋力低下および骨格筋持久力低下が合併します。心リハエントリー時に筋力や筋量を測定し、サルコペニア・フレイルの有無をきちんと評価した上で心リハプログラムを組む必要があります。
状態が安定し、サルコペニア・フレイルを伴わない場合や外来運動療法時には、有酸素運動を主体に運動療法を行います。経過中はCPXによる運動処方の見直しやサルコペニア・フレイルのモニターも行います。
一方、サルコペニア・フレイルがあれば一定期間、監視型の運動療法を行うことが困難ですので、先行して早期にレジスタンストレーニングを導入し、筋力・筋量・安定性の増加を目指した筋力トレーニングを行います。
通常の心リハプログラムは、安静が解除された後に、起こす、座る、立つ、歩くなど、重力と運動を徐々に増加させていく段階的なプログラムですが、高齢のサルコペニア・フレイル患者さんでは、歩行距離を伸ばすことに加えて、安全に立ち上がれる、バランスよく安定して立っていられることなど実際の生活に準じたリハビリテーションプログラムが重要となります。
よくベッドサイドに坐って(端坐位)、膝伸展(ひざを伸ばす)運動がよく行われますが、単に膝関節の進展を繰り返すよりも、立つ、座るなどのADL動作を繰り返した方が目的とするトレーニング効果がでやすくなります。
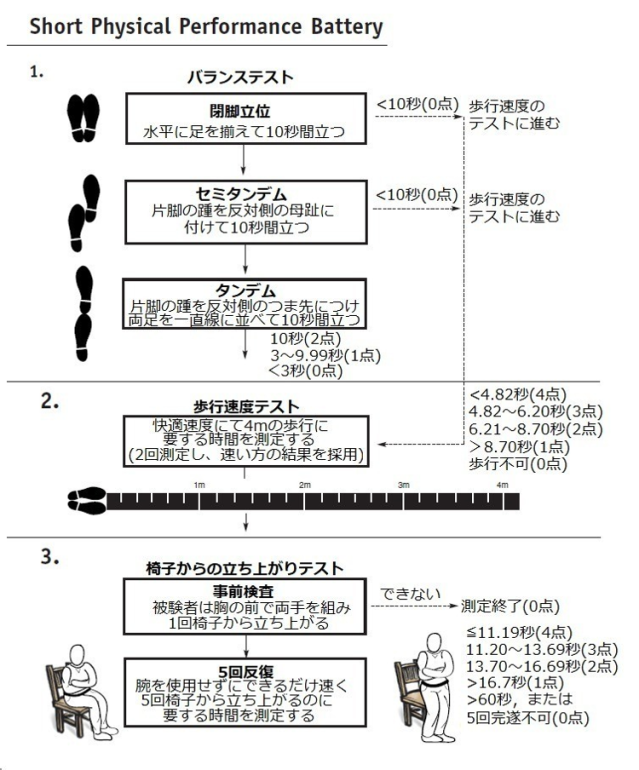
現在、身体的フレイルの評価で世界的に幅広く使用されているスクリーニングテストが、Short Physical Performance Battery (SPPB)です。National Institute on Aging(NIA)によって開発され、 1994 年に発表されました22。死亡率や施設入所の予測因子になると報告されています。
バランステストと4m歩行速度、椅子からの立ち上がり時間から構成されており、特別な器具を必要とせず、短時間で評価できるのがメリットです。12点満点で、0~6点を低機能、7~9点を中程度機能、10~12点を高機能とします。術後であったり、入院後のリハビリの目標は、術前や入院前のSPPB得点を獲得することです。
さっきのSPPBなどで定期的に評価しつつ生活動作など少しづつ動けるようになってきて、さらなる筋肥大、筋力増強を目的とした場合、高強度負荷が必要です。
しかし、とくに心不全患者さんでは高強度負荷による有害事象が高頻度で発生しており注意を要します。サルコペニアを合併した心不全患者さんでは個別的な低~中強度負荷のレジスタンス・トレーニングを全身の有酸素運動に組み合わせると、運動耐容能およびQOL改善に有効とされています。
監視下運動療法にて、1RMの20~30%あるいはBorg指数11~13(ややきつい)の範囲内で週2~3回実施し、負荷量を40~60%へ徐々に増やすことが推奨されています。
サルコペニア・フレイルの状態から、レジスタンス・トレーニングを行い、歩行可能となったらCPXで評価し運動処方を行い有酸素運動主体(+筋力トレーニング)とした運動療法を行います。
効率の良い今後期待される筋力トレーニング
低強度でもやり方自体で安全に効率よく筋量・筋肉を増やせないか、ローリスク、ハイリターンのトレーニングであればぜひ取り入れたいですよね。いくつか期待されるものがありますのでご紹介します。
電気刺激療法EMS
心疾患患者への電気刺激療法 (Electrical Muscle Stimulating: EMS)に関するレビューが報告されてきています。レビューによる適応は、一定期間の症状が安定したNYHAⅡ~Ⅳの心不全患者さんで、従来の有酸素運動やレジスタンス・トレーニングが対象となる症例でなく、筋萎縮や骨格筋異常が進行した症例で検討されています23。
メタ解析の結果では、心不全患者の最大酸素摂取量、6分間歩行距離、QOL、筋力、内皮機能、および抑うつ症状を改善すると報告されており、有酸素運動が困難なサルコペニアを合併する心不全患者さんには有効な治療法になるかもしれません24。
スロートレーニング
低強度の筋力トレーニングであっても高齢者の筋肥大に効果をおよぼすとの研究が、近年、数多く報告されるようになりました。
筋肥大の効果は力積(例:強度×回数)に影響され、強度が低くても回数を多く行うことで、高強度の筋力トレーニングと同等の効果が得られ、筋線維タイプの違いによる肥大の差も認められませんでした25。
高齢者の筋タンパク質合成速度でも同様の結果が報告されており26、低強度であっても段階的に回数を増加させることによって、高齢者の筋肥大あるいは筋萎縮の抑制が期待されます。
また、低強度(50% 1RM, 8回×3セット, 2回/週, 12週間) であっても、負荷の上げ下げをそれぞれ3秒以上でゆっくり行うスロートレーニング(スロトレ)により、高齢者(59~76歳)の筋肥大効果が認められたとの報告もあります27。
スロトレは血圧を上げず、動脈スティフネスを下げることが明らかになっており、血圧上昇や動脈硬化が懸念される高齢者の筋力トレーニングとして注目されています28。
低強度であっても動作をゆっくり行うことで筋量・筋力増加が期待できると報告されており、心不全患者さんへも応用可能ですね.。
加圧トレーニング
加圧トレーニング29 は健常者やアスリートを対象に開発され、加圧しながら小さいレジスタンス・トレーニングを行うことで成長ホルモンが分泌され、運動筋に筋肥大を引き起こすとされています。
また、前負荷軽減による心臓の仕事量を軽減することや血管内皮機能の改善効果により動脈硬化性疾患にも適応があるとされ、心疾患にも応用されることが期待されています。
通常のレジスタンス・トレーニングは1RM(1回持ち上げられる最大の重さ)の60~80%程度ですが、加圧トレーニングでは1RMの20~30%(25~30回程度連続して持ち上げられる重さ)で同じ効果が得られる、と言われています。
心疾患患者に対する加圧トレーニングは、安全性や効果的な運動負荷に関して一定のコンセンサスが得られていませんが、今後詳細に検討され応用されることが期待されます。
まとめ
筋肉は成人男性で体重の約40%、成人女性で約35%を占め、体の中で最大の臓器・組織です。それにもかかわらず、今まで気に留めずに生活してきた方が多いと思います。
医療者側も検査データの異常値だけを薬物で補正する一辺倒の治療に終始する場合も多いかもしれません。もちろんそれも必要最低限しないといけないことですが、その奥に潜む原因にも目を向け、筋肉や筋力を維持することをもっともっと啓蒙していかないと高齢化社会は要介護者であふれてしまいます。
第2の心臓である筋肉がおとろえると心血管病にもなりやすく長生きできません。人生の最後まで自分の足でしっかり歩き自分らしい人生を生きる健康寿命をつかむために筋活をして貯筋に励みましょう!
当院で包括的な心臓リハビリテーションを通じて、そのお手伝いが少しでもできればとてもうれしいです!
そして、“先立つもの”がなければ、筋肉は維持できません。
次回は、筋肉をつくる源である栄養について、心リハシリーズの最終章をお話しさせていただく予定です。
以上
当記事の執筆者
 高松ささき内科ハートクリニック 院長
高松ささき内科ハートクリニック 院長
医学博士/総合内科専門医/循環器専門医
日本大学医学部を卒業。国立循環器病研究センター勤務、大阪大学医学部で医学博士号を取得後、アメリカの名門ジョンズ・ホプキンズ大学付属病院での勤務等を経て現職。専門は心臓と血管。
最寄駅:JR高松駅(香川県)徒歩10分強
参考文献
1.Kamiya K et al. Quadriceps Strength as a Predictor of Mortality in Coronary Artery Disease. Am J Med. 2015;128:1212-9. doi: 10.1016/j.amjmed.2015.06.035.
2.Stephanie Studenski et al. Gait speed and survival in older adults. JAMA. 2011;305(1):50-58. doi:10.1001/jama.2010.1923
3.Alfonso J Cruz-Jentoft et al. (EWGSOP2)Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing. 2010;39(4):412-23. doi:10.1093/ageing/afq034.
4.Alfonso J Cruz-Jentoft et al. (EWGSOP2) Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48:16-31. doi: 10.1093/ageing/afy169.
5.Liang-Kung Chen et al. Sarcopenia in Asia: consensus report of the Asian Working Group for Sarcopenia. J Am Med Dir Assoc. 2014 ;15:95-101. doi: 10.1016/j.jamda.2013.11.025.
6.荒井秀典他編:フレイル診療ガイド2018年版. ライフ・サイエンス. 東京. 2018.
7.Yamada M, Arai H, Share Predictive Value of Frailty Scores for Healthy Life Expectancy in Community-Dwelling Older Japanese Adults. J Am Med Dir Assoc. 2015;16(11):1002.e7-11.
doi: 10.1016/j.jamda.2015.08.001.
8.Kromhout D et al. Dietary fibre and 10-year mortality from coronary heart disease, cancer, and all causes. The Zutphen study. Lancet. 1982;2(8297):518-22.
doi: 10.1016/s0140-6736(82)90600-6.
9.Woods NF et al. Frailty: emergence and consequences in women aged 65 and older in the Women’s Health Initiative Observational Study. J Am Geriatr Soc. 2005 Aug;53(8):1321-30.
doi: 10.1111/j.1532-5415.2005.53405.x.
10.Newman AB et al. Association of long-distance corridor walk performance with mortality, cardiovascular disease, mobility limitation, and disability. JAMA. 2006;295(17):2018-26.
doi: 10.1001/jama.295.17.2018
11.McNallan SM et al. Measuring frailty in heart failure: a community perspective. Am Heart J. 2013;166(4):768-74.
doi: 10.1016/j.ahj.2013.07.008.
12.Fulster S et al. Measuring frailty in heart failure: a community perspective. Am Heart J. 2013;166(4):768-74.
doi: 10.1016/j.ahj.2013.07.008.
13.Kamiya K et al. Prognostic Usefulness of Arm and Calf Circumference in Patients ≥65 Years of Age With Cardiovascular Disease. Am J Cardiol. 2017;119(2):186-191.
doi: 10.1016/j.amjcard.2016.09.040.
14.Sergi G et al. Pre-frailty and risk of cardiovascular disease in elderly men and women: the Pro.V.A. study. J Am Coll Cardiol. 2015;65(10):976-83. doi:10.1016/j.jacc.2014.12.040.
15.Xue QL et al. Initial manifestations of frailty criteria and the development of frailty phenotype in the Women’s Health and Aging Study II. J Gerontol A Biol Sci Med Sci. 2008;63(9):984-90.
doi: 10.1093/j.amjcard.2016.09.040
16.Cicoira M et al. Skeletal muscle mass independently predicts peak oxygen consumption and ventilatory response during exercise in noncachectic patients with chronic heart failure. J Am Coll Cardiol. 2001;37(8):2080-5. doi: 10.1016/s0735-1097(01)01306-7.
17.Hulsmann M et al. Muscle strength as a predictor of long-term survival in severe congestive heart failure. Eur J Heart Fail. 2004;6(1):101-7.
doi: 10.1016/j.ejheart.2003.07.008.
18.Braith RW et al. Resistance exercise training: its role in the prevention of cardiovascular disease. Circulation. 2006 Jun 6;113(22):2642-50. doi:10.1161/CIRCULATIONAHA.105.584060.
19.McCurdy K et al. The Reliability of 1- and 3Rm Tests of Unilateral Strength in Trained and Untrained Men and Women. J Sports Sci Med. 2004;3(3):190-196.
20.Williams MA et al. Resistance exercise in individuals with and without cardiovascular disease: 2007 update: a scientific statement from the American Heart Association Council on Clinical Cardiology and Council on Nutrition, Physical Activity, and Metabolism. Circulation. 2007;116(5):572-84.
doi:10.1161/CIRCULATIONAHA.107.185214.
21.Fletcher GF et al. Exercise standards for testing and training: a scientific statement from the American Heart Association. Circulation. 2013;128(8):873-934.
doi: 10.1161/CIR.0b013e31829b5b44.
22.Guralnik JM et al. A short physical performance battery assessing lower extremity function: association with self-reported disability and prediction of mortality and nursing home admission. J Gerontol. 1994;49(2):M85-94. doi: 10.1093/geronj/49.2.m85.
23.小澤哲也, 他. 心疾患の骨格筋と電気刺激療法. 理学療法ジャーナル. 2012;46:803-810.
24.Gomes Neto M et al. Effects of Neuromuscular Electrical Stimulation on Physiologic and Functional Measurements in Patients With Heart Failure: A SYSTEMATIC REVIEW WITH META-ANALYSIS J Cardiopulm Rehabil Prev. 2016;36(3):157-66.
doi: 10.1097/HCR.0000000000000151.
25.Morton RW et al. Neither load nor systemic hormones determine resistance training-mediated hypertrophy or strength gains in resistance-trained young men. J Appl Physiol. 2016;121(1):129-38. doi: 10.1152/japplphysiol.00154.2016.
26.Agergaard J et al. Light-load resistance exercise increases muscle protein synthesis and hypertrophy signaling in elderly men. Am J Physiol Endocrinol Metab. 2017;312(4):E326-E338.
doi: 10.1152/ajpendo.00164.2016.
27. Watanabe Y et al. Increased muscle size and strength from slow-movement, low-intensity resistance exercise and tonic force generation. J Aging Phys Act. 2013;21(1):71-84.
doi: 10.1123/japa.21.1.71.
28.山口太一、石井好二郎:筋におけるアンチエイジング. 新興医学出版社、東京. 2010:206-209.
29.佐藤義昭, 他. 加圧トレーニングの理論と実際. 東京:講談社サイエンティフィック;2007.